Comment la bioluminescence peut mener à la prochaine génération de médicaments ciblant les récepteurs RTK ?
La technologie de Domain Thérapeutiques repose sur des dosages par biocapteurs fondés sur l’ebBRET (transfert d’énergie de résonance de bioluminescence à proximité améliorée) et codés génétiquement pour caractériser les signaux de récepteurs non marqués.
La création de toutes nos technologies a le même objectif sous-jacent : favoriser la découverte de nouveaux médicaments en jetant un nouvel éclairage sur les voies de transduction du signal proximal des récepteurs transmembranaires, sans interférer avec la structure de ces récepteurs et effecteurs.
La création de la prochaine génération d’agents thérapeutiques fondée sur des savoirs enrichis et approfondis passe obligatoirement par ces deux aspects.
Après avoir validé la plateforme bioSens-All® axée sur les RCPG, nous avons transposé cette même technologie et ses avantages uniques aux récepteurs à activité tyrosine kinase (RTK). Compte tenu de l’importance de ces récepteurs en oncologie et du lourd fardeau que constitue le cancer, il devient essentiel de créer de nouveaux outils pour favoriser la découverte de médicaments novateurs dans ce domaine de la médecine.
De l’importance des RTK
Les RTK se lient à diverses molécules de signalisation et régulent de nombreux processus cruciaux tels que la survie, la différenciation et la prolifération des cellules. Il convient de noter qu’un dysfonctionnement des RTK peut perturber bon nombre de ces processus et aboutirà l’apparition de différents types de cancer. C’est pourquoi les RTK sont les cibles privilégiées des nouveaux agents anticancéreux.
Pourtant, leur plein potentiel thérapeutique reste essentiellement sous-exploité, car notre compréhension des caractéristiques biologiques complexes des RTK laisse encore à désirer.
Les mesures actuelles freinent la conception d’agents thérapeutiques novateurs axés sur les RTK
C’est un fait reconnu aujourd’hui que les différents ligands qui se lient à un même récepteur peuvent entraîner des effets biologiques différents; c’est ce qu’on appelle la sélectivité fonctionnelle ou signalisation biaisée. Si la sélectivité fonctionnelle a abondamment été décrite pour les RCPG, il n’en demeure pas moins que ce nouveau paradigme pharmacologique reste trop peu exploré du côté des RTK, notamment en raison de toute l’attention donnée à la découverte des inhibiteurs du domaine tyrosine kinase compétitifs de l’ATP. L’avenir des ligands biaisés en thérapeutique est chargé de promesses compte tenu de cette faculté qu’ils ont de moduler de façon sélective les cascades de signalisation favorables, tout en n’agissant pas sur celles qui risquent de provoquer des effets secondaires indésirables.
Il faudra donc faire plus de recherches et créer de nouvelles technologies pour bien comprendre les mécanismes proximaux et distaux qui sous-tendent la sélectivité fonctionnelle des ligands ciblant les RTK. Nous n’avons pas encore pris la pleine mesure de toute la complexité que comportent l’activité et les propriétés pharmacologiques des RTK, ce qui nuit au développement de nouveaux agents thérapeutiques ciblant des voies précises en aval.
Bon nombre des méthodes actuellement employées pour étudier l’activation des RTK et pour le criblage des inhibiteurs de RTK sont axées sur l’activité kinase de ces récepteurs. Cela dit, les dosages reposant sur l’activité kinase ont une capacité de traitement limitée et laissent de côté d’autres facteurs déterminants de l’efficacité thérapeutique des ligands, dont leurs caractéristiques cinétiques, leur emplacement et leur sélectivité fonctionnelle, d’où un portrait incomplet de la signature de signalisation d’un ligand.
De pareilles lacunes nécessitent la création de nouveaux outils pour favoriser la découverte de médicaments novateurs dans la sphère des RTK.
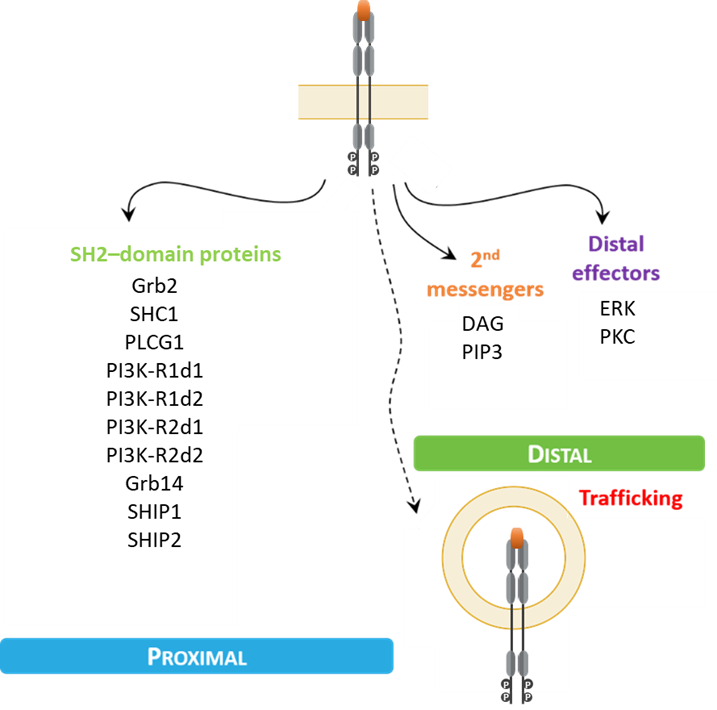
La signature signalétique: un ensemble diversifié de biosenseurs des domaines SH2 pour une caractérisation approfondie des ligands
Quand ils sont activés par un ligand donné (SME ou agent biologique), les RTK commencent à se dimériser, ce qui déclenche leur autophosphorylation et permet le recrutement d’effecteurs via les domaines SH2 aux sites phosphorylés. Ce recrutement marque le point de départ de la transduction des signaux intracellulaires et détermine la réaction biologique subséquente de la cellule.
En sachant quels effecteurs des domaines SH2 sont recrutés et dans quelle mesure, vous pourriez savoir plus facilement quelle réaction biologique provoquera votre médicament. Puisque les ligands peuvent tous recruter ces effecteurs à divers degrés, ils sont tous dotés d’un profil de transduction des signaux qui leur est propre; c’est ce que l’on appelle la signature signalétique. Le fait de posséder ces renseignements dès le début des travaux de recherche sur un médicament (étapes de détermination de la cible et d’optimisation d’un composé prometteur) peut changer la donne en permettant d’améliorer ses effets thérapeutiques et de réduire le risque d’échec d’un programme de recherche donné.
Jusqu’à maintenant, nous avons conçu des biocapteurs permettant d’examiner l’activation de 12 protéines à domaines SH2 distincts (Grb2, SHC1, PLCG1, PI3KR1-d1, PI3KR1-d2, PI3KR2-d1, PI3KR2-d2, Grb14, SHIP1, SHIP2, SHP-1 et SHP-2). Les biocapteurs proximaux composant la base de la plateforme de biocapteurs de RTK contiennent un domaine SH2 spécifique de ces protéines, fusionné à une luciférase isolée de Renilla (RlucII). Le recrutement de biocapteurs vers la membrane cellulaire au moment de l’activation d’un RTK se traduit par une augmentation de l’efficacité du BRET avec une protéine fluorescente verte de Renilla reniformis (rGFP) ancrée à la membrane cellulaire.
De plus, le même principe de translocation est utilisé pour mesurer l’internalisation des RTK avec une rGFP ancrée à un endosome précoce.
De précieuses données dont la pertinence dans les études physiologiques in vivo a été éprouvée
Les renseignements sur la signalisation proximale ne seraient pas aussi utiles si nous ne pouvions pas les relier à un effet in vivo et à des caractéristiques biologiques. Heureusement, comme les signaux que nous détectons sont à distance immédiate de la membrane cellulaire, ces renseignements ont un rapport logique avec la physiologie, en ce sens que nous pouvons observer des corrélations entre les effets thérapeutiques ou indésirables d’un ligand et sa signature signalétique. En possédant ces renseignements dès le début de la conception d’un médicament, vous augmenteriez donc vos chances de choisir et de créer le composé exerçant les effets thérapeutiques optimaux recherchés et réduirait au minimum le risque d’attrition.
Des RTK non marqués pour des données fiables et exemptes de biais sur la signalisation
La plateforme bioSens-All® offre une caractéristique unique : les données sur la signalisation qu’elle génère proviennent de RTK intacts. Par conséquent, les signatures de signalisation que nous observons sont pertinentes sur le plan physiologique.
Un trait extrêmement distinctif et important de notre technologie vient du fait que ni le récepteur ni ses effecteurs directs ne sont modifiés. En laissant ce système à l’état physiologique, on fait en sorte que les voies de signalisation activées ne sont altérées par aucun changement structurel, quel qu’il soit.
Nous savons de façon certaine que la modification d’un seul acide aminé peut avoir une influence majeure sur les propriétés biologiques d’un récepteur, lui faisant perdre partiellement ou totalement sa fonction. La beauté de notre technologie de BRET réside aussi dans sa simplicité : nous savons que ce que nous détectons est significatif physiologiquement parlant.
Cinétique en temps réel : plus d’enseignements pour favoriser la découverte de nouveaux médicaments
Tous nos biocapteurs de domaines SH2 peuvent être suivis en mode cinétique en temps réel, ce qui en révèle encore plus sur les caractéristiques biologiques et pharmacologiques des RTK. À terme, cette couche de données peut être utile pour distinguer les ligands affichant une signature de signalisation similaire par mesure en point final tout en exerçant des effets physiologiques semblables.
Ce type de mesure reste sous-exploité dans les programmes de recherche de médicaments classiques, ce qui fait de cette caractéristique un atout intéressant pour la conception de la prochaine génération de médicaments axés sur les RTK.
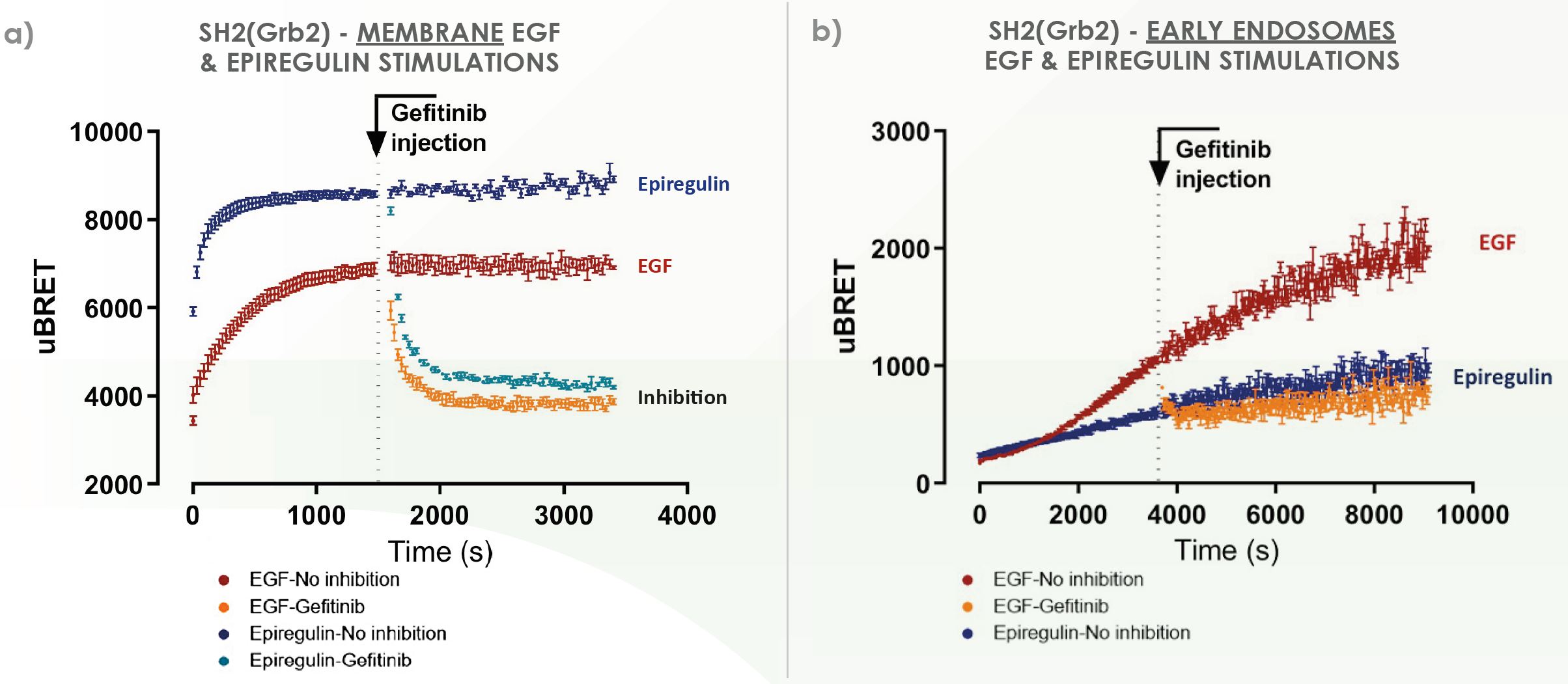
Consultez notre étude de cas avec données cinétiques en temps réel.
Caractérisation des mutants pour développer la prochaine génération de médicaments
L’efficacité de plusieurs médicaments actuels est compromise par les effets indésirables qu’ils provoquent. De plus, l’apparition de mutations somatiques ou acquises des RTK permet aux tumeurs de devenir résistantes à certains médicaments. Les mutations des RTK peuvent nuire à l’activité de ces récepteurs ou empêcher le médicament de s’y lier par divers mécanismes (p. ex. modification de l’emplacement infracellulaire du récepteur, dimérisation, signalisation/trafic et biais de signalisation cinétique). La plateforme de biosenseurs sensibles aux RTK permet de distinguer l’effet de différents Inhibiteurs de Tyrosine Kinase (ITK) sur les diverses mutations de ces récepteurs. Cette caractéristique pourra être exploitée dans le cadre de la conception de la prochaine génération d’ITK efficaces contre les variants des RTK.
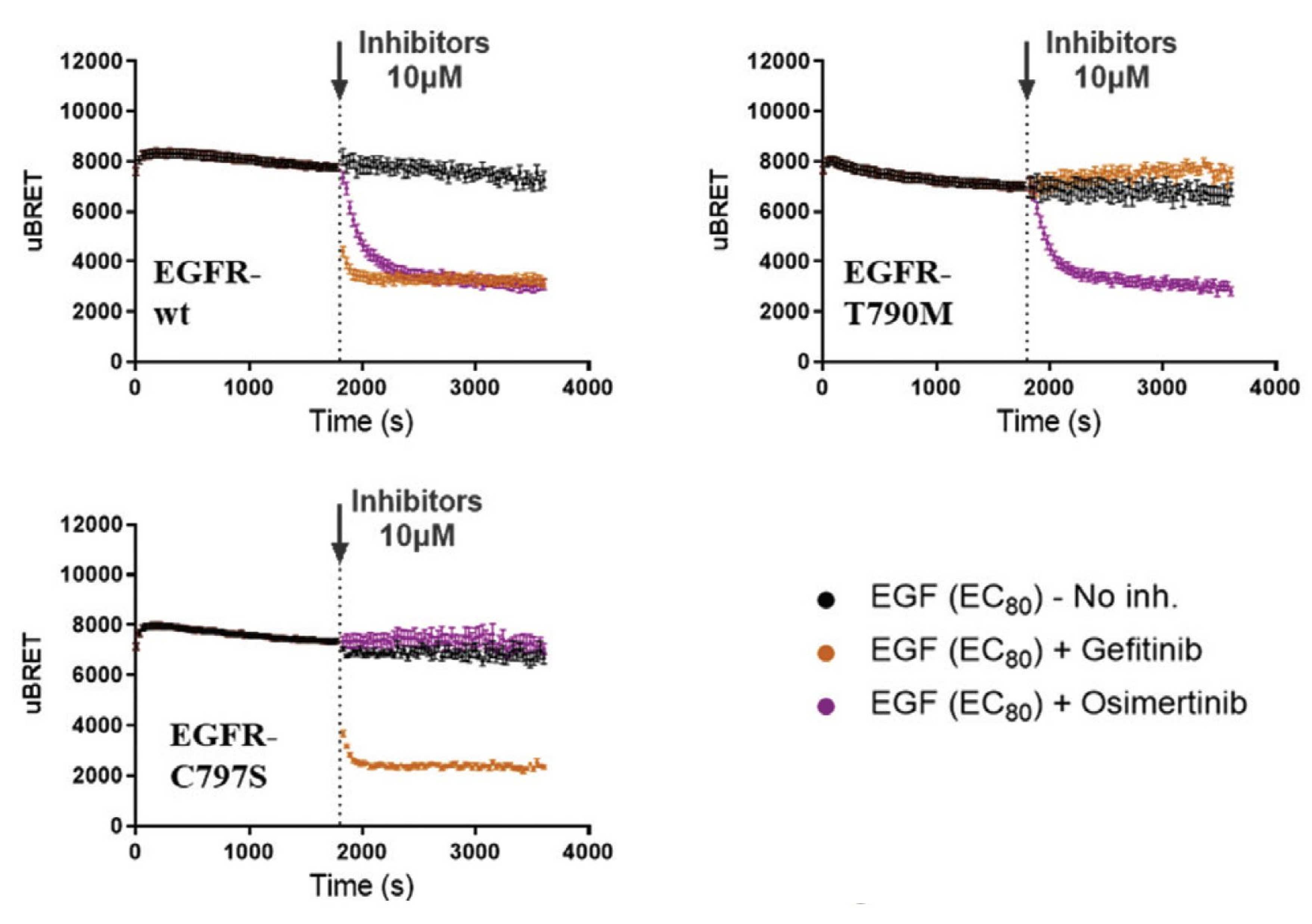
Plus d’informations sur nos capacités à profiler des mutants